Оглавление:
Закон Больцмана о равномерном распределении энергии по степеням свободы (закон равнораспределения).
Для системы, находящейся в состоянии термодинамического равновесия на каждую поступательную и вращательную степень свободы приходится в среднем кинетическая энергия, равная 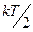 а на каждую колебательную степень свободы — в среднем энергия, равная kT.
а на каждую колебательную степень свободы — в среднем энергия, равная kT.
Энергия колебательных степеней свободы вдвое больше, поскольку колебательная система обладает равными по величине средними значениями как кинетической, так и потенциальной энергии.
Таким образом, средняя энергия молекулы  где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:
где i — сумма числа поступательных, числа вращательных и удвоенного числа колебательных степеней свободы молекулы:

В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
В идеальном газе молекулы между собой не взаимодействуют и их потенциальная энергия равна нулю. Поэтому внутренняя энергия одного моля идеального газа  и произвольной массы т газа U будут соответственно
и произвольной массы т газа U будут соответственно
 и
и 
27. Первое начало термодинамики.
Первое начало термодинамики — это закон сохранения и превращения энергии в термодинамических процессах.
Изменить внутреннюю энергию системы можно двумя способами: совершая над системой работу (например, сжимая газ в цилиндре с помощью поршня) или сообщая системе теплоту (например, нагревая газ в герметичном сосуде).
Рассмотрим замкнутую, макроскопически неподвижную систему, не находящуюся во внешних силовых полях и проанализируем с энергетической точки зрения равновесный процесс перехода системы из какого-либо начального состояния 1 в другое состояние 2.
Изменение внутренней энергии системы∆U=U1 — U2в таком процессе равно разности между количеством теплоты Q, полученным системой, и работой А , совершенной системой против внешних сил  или
или 
Первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
В дифференциальной форме 
где dU (полный дифференциал) — бесконечно малое изменение внутренней энергии системы,  — элементарная работа,
— элементарная работа, 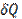 — бесконечно малое количество теплоты.
— бесконечно малое количество теплоты.  и
и  не являются полными дифференциалами.
не являются полными дифференциалами.
Дело в том, что внутренняя энергия системы является однозначной функцией состояния системы. Отсюда следует, что при совершении системой произвольного процесса, в результате которого она вновь возвращается в исходное состояние, полное изменение внутренней энергии системы равно нулю  Ни работа, ни теплота не являются функциями состояния системы.
Ни работа, ни теплота не являются функциями состояния системы.
Все величины входящие в первое начало термодинамики могут быть как положительными, так и отрицательными
Если к системе подводится теплота, то 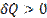 ; если от системы
; если от системы
отводится теплота, то 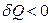
Если система совершает работу над внешними телами, то  , если же над системой внешние силы совершают работу, то
, если же над системой внешние силы совершают работу, то 
Другая формулировка первого начала термодинамики связана с тем, что если система периодически возвращается в первоначальное состояние, и следовательно  , то A=Q, т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, — невозможен.
, то A=Q, т. е. вечный двигатель первого рода — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, — невозможен.
28.Работа газа при его расширении.
 Если находящийся под поршнем в цилиндрическом сосуде, газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работу
Если находящийся под поршнем в цилиндрическом сосуде, газ, расширяясь, передвигает поршень на расстояние dl, то производит над ним работу
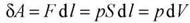 ,
,
где S — площадь поршня.
Полная работа A, совершаемая газом при изменении его объема от 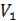 до V2:
до V2: 
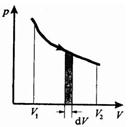 Равновесные процессы — это процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностью реальных процессов можно пренебречь.
Равновесные процессы — это процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны, но в ряде случаев (достаточно медленные процессы) неравновесностью реальных процессов можно пренебречь.
Равновесные процессы можно изображать графически в координатах (p,V). Так работа  определяется площадью заштрихованной полоски, а полная работа — площадью под кривой между Vl и V2. При неравновесных процессах значения параметров в разных частях системы различны и не существует (p,V) -точек, характеризующих состояние всей системы. Поэтому графическое изображение неравновесного процесса невозможно.
определяется площадью заштрихованной полоски, а полная работа — площадью под кривой между Vl и V2. При неравновесных процессах значения параметров в разных частях системы различны и не существует (p,V) -точек, характеризующих состояние всей системы. Поэтому графическое изображение неравновесного процесса невозможно.
Удельная теплоемкость вещества с-величина, равная количеству теплоты, необходимому для нагревания 1кг вещества на 1 К. Единица удельной теплоемкости — Дж/(кг К) 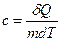
Молярная теплоемкость 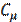 — величина, равная количеству теплоты, необходимому для нагревания 1моль вещества на 1 К. Единица молярной теплоемкости — Дж/(моль К).
— величина, равная количеству теплоты, необходимому для нагревания 1моль вещества на 1 К. Единица молярной теплоемкости — Дж/(моль К). 
Связь между 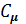 и с
и с 
Различают теплоемкости (удельную и молярную) при постоянном объеме ( 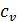 и
и  ) и при постоянном давлении (
) и при постоянном давлении ( 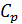 и
и 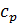 ), если в процессе нагревания вещества его объем или давление поддерживаются постоянными.
), если в процессе нагревания вещества его объем или давление поддерживаются постоянными.
30. Молярная теплоемкость при постоянном объеме.
Из первого начала термодинамики 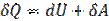 , с учетоми
, с учетоми 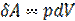
 , для 1моль газа получим
, для 1моль газа получим 
При V = const работа внешних сил  равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии
равна нулю и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии 
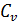 равна изменению внутренней энергии 1моль газа при повышении его температуры на 1 К.
равна изменению внутренней энергии 1моль газа при повышении его температуры на 1 К.
Поскольку d  , то
, то 
31.Молярная теплоемкость при постоянном давлении. Уравнение Майера.
Если газ нагревается при р = const, то

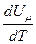 не зависит от вида процесса (внутренняя энергия идеального газа не
не зависит от вида процесса (внутренняя энергия идеального газа не
зависит ни от р, ни от V, а определяется только Т) и всегда равна  . Дифференцируя уравнение Клапейрона-Менделеева
. Дифференцируя уравнение Клапейрона-Менделеева 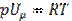 по Т при р = const, получим
по Т при р = const, получим
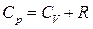 — уравнение Майера.
— уравнение Майера.
Cp всегда больше CV на величину универсальной газовой постоянной.
Это объясняется тем, что при нагревании газа при постоянном давлении требуется еще дополнительное количество теплоты на совершение работы расширения газа, так как постоянство давления обеспечивается увеличением объема газа.
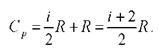
При рассмотрении термодинамических процессов важную роль играет величина 
которая называется коэффициентом Пуассона.
ИЗОПРОЦЕССЫ. Рассмотрим равновесные процессы, происходящие с термодинамическими системами, при которых один из основных параметров состояния сохраняется постоянным.
32.Изохорный процесс(V = const).
 Диаграмма этого процесса — изохора — в координатах (p,V) изображается прямой, параллельной оси ординат (ось р). Процесс 2-1 — изохорный нагрев, процесс 2-3 — изохорное охлаждение.
Диаграмма этого процесса — изохора — в координатах (p,V) изображается прямой, параллельной оси ординат (ось р). Процесс 2-1 — изохорный нагрев, процесс 2-3 — изохорное охлаждение.
При изохорном процессе газ не совершает работу над внешними телами 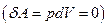 и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии
и вся теплота, сообщаемая газу, идет на увеличение его внутренней энергии 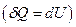 . Поскольку
. Поскольку 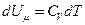 , то для произвольной массы газа
, то для произвольной массы газа

33. Изобарный процесс(р = const).
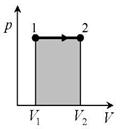 Диаграмма этого процесса — изобара — в координатах (p,V) изображается прямой параллельной оси абсцисс (ось V). При изобарном процессе работа газа при увеличении объема от
Диаграмма этого процесса — изобара — в координатах (p,V) изображается прямой параллельной оси абсцисс (ось V). При изобарном процессе работа газа при увеличении объема от  до
до  равна
равна 
и определяется площадью заштрихованного прямоугольника. Используя уравнение Клапейрона pV=  , получаем
, получаем  , отсюда
, отсюда 
Физический смысл универсальной газовой постоянной: R численно равна работе изобарного расширения 1 моля идеального газа при нагревании его на 1 К.
34.Изотермический процесс (Т = const).
 Диаграмма этого процесса — изотерма — в координатах (p,V) представляет собой гиперболу. Изотермический процесс описывается законом Бойля-Мариотта (pV = const).
Диаграмма этого процесса — изотерма — в координатах (p,V) представляет собой гиперболу. Изотермический процесс описывается законом Бойля-Мариотта (pV = const).
Работа изотермического расширения газа

Так как при Т = const внутренняя энергия идеального газа не изменяется, то из первого начала термодинамики следует, что  , то есть все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
, то есть все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
Поэтому, для того, чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
35.Адиабатический процесс (  )
)
Адиабатическим называется процесс, при котором отсутствует теплообмен между системой и окружающей средой (  ).
).
К адиабатическим процессам можно отнести все быстропротекающие процессы (теплообмен не успевает совершиться), например, распространение звука в среде, циклы расширения и сжатия в двигателях внутреннего сгорания, в холодильных установках и т. д.
Из первого начала термодинамики следует, что при адиабатическом процессе 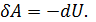 Используя
Используя  и dU=
и dU=  , получим
, получим  (1).
(1).
С другой стороны, из pV= 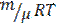 следует
следует  . Разделив (2) на (1) получим
. Разделив (2) на (1) получим
 или
или 
где  — коэффициент Пуассона. Интегрирование этого уравнения дает
— коэффициент Пуассона. Интегрирование этого уравнения дает
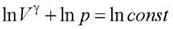
 откуда следует уравнение Пуассона — уравнение адиабатического процесса.
откуда следует уравнение Пуассона — уравнение адиабатического процесса. 
Используя уравнение Менделеева-Клапейрона  получаем:
получаем: 
Диаграмма адиабатического процесса — адиабата — в координата (p,V) изображается гиперболой. Адиабата  более крута, чем изотерма (pV = const). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, но и повышением температуры.
более крута, чем изотерма (pV = const). Это объясняется тем, что при адиабатическом сжатии 1-3 увеличение давления газа обусловлено не только уменьшением его объема, но и повышением температуры.
36.Работа газа в адиабатическом процессе.
В адиабатическом процессе  , поэтому
, поэтому  . Если газ адиабатически расширяется от объема
. Если газ адиабатически расширяется от объема  до
до 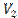 , то его температура уменьшается от T1 до Т2 и работа расширения идеального газа
, то его температура уменьшается от T1 до Т2 и работа расширения идеального газа

Откуда получаем 
используя уравнение Менделеева-Клапейрона 
Работа адиабатического расширения 1-2 (заштрихованная площадь) меньше, чем при изотермическом процессе. Это объясняется тем, что при адиабатическом расширении происходит охлаждение газа, тогда как при изотермическом расширении температура поддерживается постоянной за счет притока извне эквивалентного количества теплоты.
37.Политропические процессы(С = const).
Процесс, в котором теплоемкость остается постоянной (С = const) называется поли тропическим.
Рассмотренные выше изохорный, изотермический, изобарный и адиабатический процессы — это частные случаи политропного процесса.
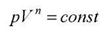
где коэффициент n= 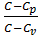 называется показателем политропы.
называется показателем политропы.
Значения теплоемкости и показателя политропы для разных процессов приведены в таблице.
 Теплоемкость при изотермическом процессе бесконечно велика, поскольку dT=0, в то время как
Теплоемкость при изотермическом процессе бесконечно велика, поскольку dT=0, в то время как 
Теплоемкость при адиабатическом процессе равна нулю, поскольку  , в то время как dT
, в то время как dT 
38.Круговой процесс (цикл).
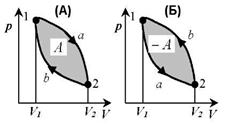 Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На (p,V) -диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 — сжатию газа.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное состояние. На (p,V) -диаграмме цикл изображается замкнутой кривой, где участок 1-2 соответствует расширению, а 2-1 — сжатию газа.
Работа расширения  (площадь фигуры la
(площадь фигуры la  ) положительна:
) положительна:  > 0.
> 0.
Работа сжатия А2 (площадь фигуры 2bl  ) отрицательна: А2
) отрицательна: А2
Дата добавления: 2014-10-31 ; просмотров: 40 ; Нарушение авторских прав
lektsii.com
Барометрическая формула. Распределение Больцмана. Закон равномерного распределения энергии по степеням свободы.
Барометрическая формула:
 ,
,
где p — давление газа в слое, расположенном на высоте h ,
p0 — давление на нулевом уровне h = h0 ,
M — молярная масса газа,
R — газовая постоянная,
T — абсолютная температура.
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты в соответствии с законом распределения Больцмана:

Где:
n — концентрация молекул на высоте h ,
n0 — концентрация молекул на начальном уровне h = 0 ,
m — масса частиц,
g — ускорение свободного падения,
k — постоянная Больцмана,
T — температура.
В статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная  , а на каждую колебательную степень свободы — в среднем энергия, равная kT . Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы:
, а на каждую колебательную степень свободы — в среднем энергия, равная kT . Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы:
 ,
,
где i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы: i = iпост. + iвращ. + 2iколеб.
Закон равнораспределения показывает, что при тепловом равновесии, любая степень свободы (компоненты векторов положения или скорость частицы), которая появляется только как квадратичная функция в энергии, обладает средней энергией равной ½k в T и поэтому вносит вклад ½k в теплоёмкость системы.
malishev.info
Рефераты и конспекты лекций по географии, физике, химии, истории, биологии. Универсальная подготовка к ЕГЭ, ГИА, ЗНО и ДПА!
Физика — рефераты, конспекты, шпаргалки, лекции, семинары
Закон о равномерном распределении энергии по степеням свободы молекул
Число степеней свободы (и) — число независимых переменных, полностью определяют положение тела (системы) в пространстве.
Так, число степеней свободы материальной точки, свободно движется в пространстве, равно трем (координаты x, y и z), по плоскости — двум (координаты х и у).
В классической механике молекулу одноатомного газа рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать. Молекулу двухатомного газа в первом приближении рассматривается как совокупность двух жестко связанных материальных точек, то есть деформации молекул не учитывают. Такая система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) можно не учитывать из-за точечности атомов. Таким образом, двухатомный газ имеет пять степеней свободы. Трехатомные и многоатомные молекулы имеют шесть степеней свободы:
три поступательные и три вращательные. Конечно, жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения. Независимо от общего числа степеней свободы молекул три из них всегда поступательные. В классической теории рассматривают молекулы с жесткой связью между атомами, для них отсутствуют колебательные степени спободы.
Следует отметить, что закон Больцмана является приближенным (полученный на основе классических представлений о характере движения молекул), и пересмотрен в квантовой статистике. Колебательный степень «нет» вдвое большую энергию так, что на него приходится не только кинетическая энергия (как в случае поступательного и вращательного движения), но и потенциальная, причем средние значения кинетической и потенциальной энергий одинаковые. Таким образом, согласно закону о равномерном распределении энергии по степеням свободы.
worldofscience.ru
Это и есть закон Больцмана о равномерном распределении средней кинетической энергии по степеням свободы
Если система находится в состоянии термодинамического равновесия, при температуре Т, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы. На каждую поступательную iп и вращательную iврстепени свободы приходится энергия 1/2 kT. Для колебательной iкол, степени свободы она равна kT. Таким образом число степеней свободы i = iп + iвр + 2iкол
Внутренняя энергия 1 моль идеального газа равна сумме кинетических энергий NA молекул
и изменение внутренней энергии 1 моль идеального газаdUm =(iR/2)dT
Внутренняя энергия произвольной массы m идеального газаU = (m/M)(iRT/2)=n(iRT/2), где М — молярная масса, n = m/M — количество вещества.
Где I – момент инерции молекулы вокруг оси, проходящей через центр инерции молекулы; l = 0,1,2,… — вращательное квантовое число. Расстояние между соседними уровнями энергии вращения ΔEвр приблизительно в тысячу раз меньше ΔEкол
Для двухатомных молекул: 
для трехатомных молекул: 
В общем случае для молярной массы газа 

Для произвольного количества газов: 

Из теории также следует, что СV не зависит от температуры .
Для одноатомных газов это выполняется в очень широких пределах, а для двухатомных газов только в интервале от 100 до 1000 К.
В классической статистической физике доказывается так называемая теорема о равномерном распределении энергии по степеням свободы:
Если система молекул находится в тепловом равновесии при температуре T, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна 
Из этой теоремы следует, что молярные теплоемкости газа Cp и CV и их отношение γ могут быть записаны в виде
studopedia.info
Гипотеза о равнораспределении энергии по степеням свободы;
Степени свободы —называют число независимых координат, определяющих положение системы, или в интересующем нас случае — молекулы.
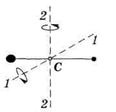 Для определения положения центра масс молекулы необходимо задать три координаты. Это означает, что молекула имеет три поступательных степени свободы.
Для определения положения центра масс молекулы необходимо задать три координаты. Это означает, что молекула имеет три поступательных степени свободы.
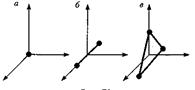
· Если молекула двухатомная и жесткая («гантель»), то, кроме трех поступательных степеней свободы, она имеет и две вращательные, связанные с углами поворота вокруг двух взаимно перпендикулярных осей 1-1 и 2-2, проходящих через центр масс С, как показано на рисунке. Вращение вокруг оси молекулы для материальных точек лишено смысла.
Таким образом, жесткая двухатомная молекула имеет пять степеней свободы: три поступательных и две вращательных.
· Если молекула упругая, то возможны колебания атомов и необходима еще одна степень свободы (расстояние между атомами). Ее называют колебательной.
· молекулу одноатомного газа (рис. а) рассматривают как материальную точку, которой приписывают три степени свободы поступательного движения. При этом энергию вращательного движения можно не учитывать.
Таким образом; одноатомный газ обладает тремя степенями свободы (i=3).
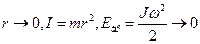 ,
,
Где I- момент инерции для материальной точки
· В классической механике молекула двухатомного газа в первом приближении рассматривается как совокупность двух материальных точек, жестко связанных недеформируемой связью (рис. б). Эта система кроме трех степеней свободы поступательного движения имеет еще две степени свободы вращательного движения. Вращение вокруг третьей оси (оси, проходящей через оба атома) лишено смысла.
Таким образом; двухатомный газ обладает пятью степенями свободы (i= 5).
· Трехатомная (рис. в) и многоатомная нелинейные молекулы имеют шесть степеней свободы: три поступательных и три вращательных. Естественно, что жесткой связи между атомами не существует. Поэтому для реальных молекул необходимо учитывать также степени свободы колебательного движения.
Независимо от общего числа степеней свободы молекул три степени свободы всегда поступательные. Ни одна из поступательных степеней свободы: имеет преимущества перед другим поэтому на каждую из них приходит в среднем одинаковая энергия, равна 1/3 значения 
 (1)
(1)
В классической статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул:
studopedia.su